- · 中国微创外科杂志版面费[06/01]
- · 《中国微创外科杂志》投[06/01]
- · 《中国微创外科杂志》期[06/01]
学科交叉合作助力胃癌精准诊疗 ——《科学》杂
作者:网站采编关键词:
摘要:2021年12月17日,北京大学肿瘤医院季加孚教授研究团队和北京大学生物医学前沿创新中心(BIOPIC)、生命科学学院、北京未来基因诊断高精尖创新中心(ICG)张泽民教授团队合作,在国
2021年12月17日,北京大学肿瘤医院季加孚教授研究团队和北京大学生物医学前沿创新中心(BIOPIC)、生命科学学院、北京未来基因诊断高精尖创新中心(ICG)张泽民教授团队合作,在国际权威学术期刊《科学》(Science, IF:47.728)主刊在线发表题为“Pan-cancer single-cell landscape of tumor-infiltrating T cells (泛癌症肿瘤浸润T细胞的单细胞图谱)”论文。联合研究团队在国际上首次从单细胞水平对包括胃癌在内的21种癌症的肿瘤浸润T细胞进行深入系统分析,结合单细胞基因表达谱和T细胞受体序列,系统刻画了肿瘤浸润性T细胞的异质性和动态性,并系统比较了不同癌症类型之间的异同,为精准靶向胃癌等多癌种内浸润T细胞的免疫治疗提供了重要理论基础。
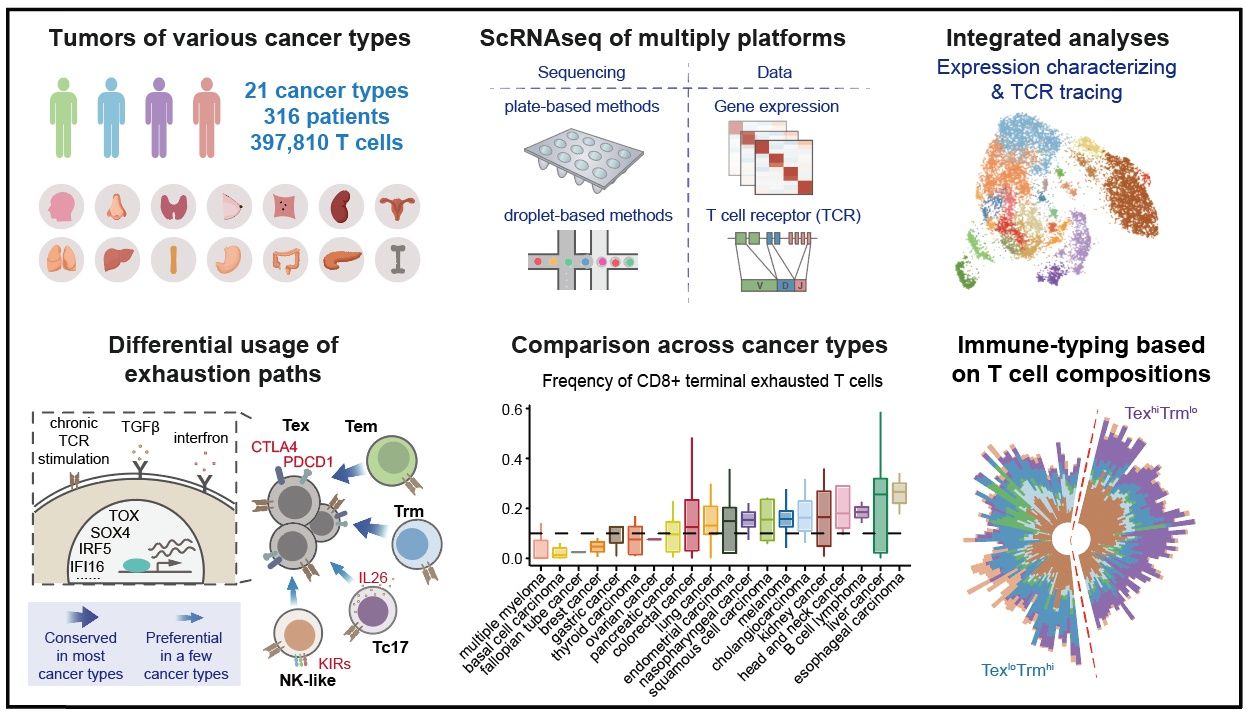
图1:T细胞单细胞图谱的研究框架和主要发现
胃癌是严重危害中国人健康的恶性肿瘤,全球年新发病例逾百万,中国占44%,主要的临床问题是危害大、治疗难、预后差。相对其他肿瘤而言,胃癌治疗手段有限,药物选择相对较少,基于标准化治疗基础上的胃癌精准医疗的创新进展,有赖于对胃癌在内的癌细胞更加深层次的刻画,为寻找新型治疗靶点提供理论依据。
季加孚教授和张泽民教授合作团队从临床问题出发,强强联手,利用学科交叉优势,通过整合团队自己产出的单细胞转录组测序数据及已发表的公共数据,构建了胃癌为代表的15个癌种内的髓系细胞图谱,并系统性地比较了各髓系细胞类群在不同癌种间组成、发育及功能上的异同,相关研究成果已于2021年2月发表于国际期刊《细胞》(CELL)杂志上。
在此基础上,研究团队进而构建了系统的单细胞水平泛癌症T细胞图谱,图谱涵盖了来自21种癌症类型的316名患者的397,810个高质量T细胞数据。共识别出17个CD8+ T细胞类群和24个CD4+ T细胞类群。不同组织来源的T细胞在组成上差异明显,表明肿瘤微环境明显地重塑了肿瘤浸润T细胞状态。
同时,研究揭示了CD8+ T细胞耗竭的两条常见路径,即分别通过效应记忆T细胞或组织驻留记忆T细胞达到终末耗竭状态。对于 CD4+ T细胞,研究发现肿瘤中的两种T滤泡辅助细胞,并进一步发现其与肿瘤突变负荷相关,提示了肿瘤细胞是如何塑造肿瘤微环境。最后根据肿瘤浸润T细胞的组成,肿瘤患者可以分为末期耗竭CD8+ T细胞占比高与组织驻留记忆CD8+ T细胞占比高的两个亚组群。基于T细胞的肿瘤免疫分型为理解肿瘤浸润T细胞的总体特性提供了理论基础,为开发新的癌症免疫疗法和患者筛选提供了理论依据。
联合研究团队进一步深入研究胃癌的肿瘤浸润T细胞组成及其转化路径,发现胃癌中的肿瘤浸润终末耗竭性T细胞主要通过ZNF683+CXCR6+组织驻留记忆T细胞即P2路经转化而来,而对于CD4+ T细胞群,TNFRSR9+ Treg则更多由SIPR1+Treg转化而来,研究为精准靶向胃癌肿瘤微环境中的特定肿瘤浸润T细胞提供了理论依据。研究发现胃癌肿瘤组织中的终末耗竭性T细胞、TNFRSR9+ Treg和TCF+耗竭性T细胞水平偏低,而ZNF683+CXCR6+组织驻留记忆T细胞水平则较高。研究者进一步深入分析胃癌和其他肿瘤组织中的T细胞组成,发现胃癌肿瘤组织中存在较低比例的终末耗竭CD8+T细胞和较高比例的组织驻留记忆CD8+T细胞,暗示胃癌肿瘤微环境中具有较好的抗肿瘤T细胞组成,为进一步开发胃癌的精准靶向免疫治疗提供了理论依据。基于单细胞转录组数据的肿瘤T细胞组分分析将有望于肿瘤免疫治疗患者的精准筛选。
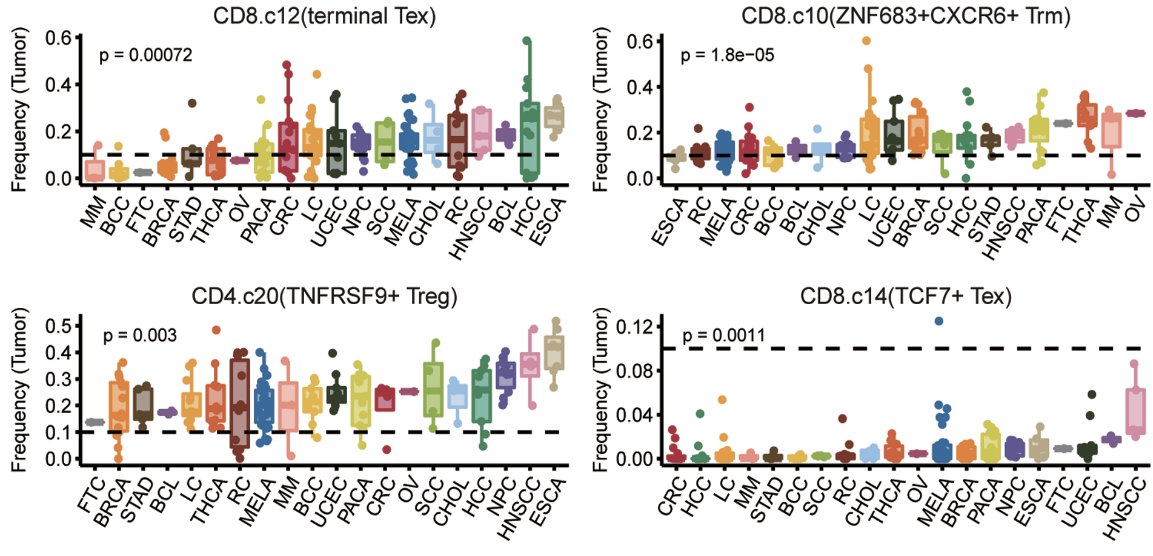
图2:泛癌肿瘤浸润T细胞分布情况
季加孚教授是我国胃癌外科及转化研究领域的学科带头人,在胃癌模块化手术、微创手术、围手术期诊疗模式建立等多个方面做了大量开拓性工作。近年来,大力推动学科交叉合作,引领中国胃癌诊疗向精准化与个体化快速发展。
随着肿瘤治疗进入精准医学和免疫治疗时代,胃癌临床问题突出表现为肿瘤异质性显著,免疫微环境复杂,治疗手段有限,效果欠佳。针对该问题,季加孚教授积极推动学科交叉合作,通过系列研究,打破学科藩篱,努力探索胃癌精准诊疗新手段。此前,季加孚团队与美国MD安德森癌症中心梁晗团队合作,通过多组学研究首次描绘了胃癌新辅助化疗前后肿瘤基因组演化图谱及免疫微环境组分变化,对胃癌新辅助化疗患者的精准筛选具有重要临床指导价值,研究成果于2020年发表于《科学》子刊Science Advances上。此外,季加孚团队与北京大学工学院席建忠团队合作,首创保留原发肿瘤微环境特征的新型“微球”模型,成功将药敏时间缩短到14天,准确性达到93.6%,使临床应用成为可能,成果于2020年发表于《科学》子刊Science Translational Medicine上。自2018年开始历时三年,季加孚教授牵头我国自主研发的双特异性抗体PD-1/CTLA-4(AK104, First in class)联合化疗治疗晚期胃癌患者的Ib-II期研究(NCT0),研究初步结果被2022年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO-GI 2022)接收为大会发言,将胃癌晚期一线患者中位生存提高到17.4个月。同时,AK104联合化疗在胃癌一线的III期研究也于今年8月份正式开展(NCT0)。
文章来源:《中国微创外科杂志》 网址: http://www.zgwcwkzz.cn/zonghexinwen/2021/1219/524.html
上一篇:山东省立三院脊柱脊髓外科增设骨与软组织肿瘤
下一篇:广州市妇女儿童医疗中心肝胆外科
中国微创外科杂志投稿 | 中国微创外科杂志编辑部| 中国微创外科杂志版面费 | 中国微创外科杂志论文发表 | 中国微创外科杂志最新目录
Copyright © 2021 《中国微创外科杂志》杂志社 版权所有 Power by DedeCms
投稿电话: 投稿邮箱: